1 Tablette enthält 5 mg, 10 mg, 15 mg oder 20 mg Ruxolitinib als Phosphat. Das Präparat enthält Laktose.
| Name | Inhalt des Pakets | Der Wirkstoff | Preis 100% | Zuletzt geändert |
| Jakavi | 56 Stück, Tisch | Ruxolitinib | 2019-04-05 |
Aktion
Ein Krebsmedikament, ein Proteinkinase-Inhibitor. Ruxolitinib ist ein selektiver Inhibitor der Janus-Kinasen (JAK), JAK1 und JAK2, die die Signalübertragung für eine Reihe von Zytokinen und Wachstumsfaktoren vermitteln, die eine wichtige Rolle bei der Hämopoese und der Immunfunktion spielen. Es zeichnet sich durch hohe Permeabilität, gute Löslichkeit und schnelle Freisetzung aus. Es wird nach oraler Verabreichung schnell resorbiert, Cmax wird ca. 1 Stunde nach der Dosierung erreicht. Die Bindung an Plasmaproteine beträgt etwa 97%, hauptsächlich an Albumin. Ruxolitinib überschreitet nicht die Blut-Hirn-Schranke. Es wird hauptsächlich durch CYP3A4 metabolisiert, mit zusätzlichem Beitrag von CYP2C9. Im Plasma liegt das Arzneimittel hauptsächlich als unverändertes Arzneimittel und als zwei aktive Metaboliten vor. Ruxolitinib wird hauptsächlich durch den Stoffwechsel ausgeschieden. Die mittlere T0.5-Elimination von Ruxolitinib beträgt ca. 3 Stunden und wird hauptsächlich im Urin und im Kot ausgeschieden.
Dosierung
Oral. Die Behandlung sollte nur von einem Arzt eingeleitet werden, der Erfahrung mit der Verabreichung von Krebsmedikamenten hat. Vor Beginn der Behandlung sollte ein vollständiges Blutbild mit einem Test der weißen Blutkörperchen durchgeführt werden. Das vollständige Blutbild mit Abstrich der weißen Blutkörperchen sollte alle 2 bis 4 Wochen durchgeführt werden, bis sich die Dosis stabilisiert hat, und dann abhängig von den klinischen Indikationen. Anfangsdosis. Myelofibrose: 15 mg zweimal täglich bei Patienten mit Thrombozytenzahlen zwischen 100.000 / mm3 und 200.000 / mm3 und 20 mg zweimal täglich bei Patienten mit Thrombozytenzahlen> 200.000 / mm3. Polyzythämie Vera: 10 mg oral zweimal täglich. Es liegen nur begrenzte Informationen zur empfohlenen Anfangsdosis für Patienten mit Thrombozytenzahlen zwischen 50.000 / mm3 und 3 - max. Die bei diesen Patienten empfohlene Anfangsdosis beträgt 5 mg zweimal täglich und sollte mit Vorsicht erhöht werden. Dosisänderungen. Die Dosen können je nach Sicherheit und Wirksamkeit des Arzneimittels angepasst werden. Die Behandlung sollte abgebrochen werden, wenn die Thrombozytenzahl weniger als 50.000 / mm3 oder die absolute Neutrophilenzahl weniger als 500 / mm3 beträgt. Die Behandlung sollte auch bei PV-Patienten abgebrochen werden, wenn der Hämoglobinspiegel unter 8 g / dl liegt. Nachdem die Anzahl der Blutwerte über diese Werte erhöht wurde, kann das Arzneimittel in einer Dosis von 5 mg zweimal täglich mit allmählicher Erhöhung auf der Grundlage der Ergebnisse eines vollständigen Bluttests mit Abstrich neu gestartet werden. Eine Dosisreduktion sollte in Betracht gezogen werden, wenn die Thrombozytenzahl unter 100.000 / mm3 fällt, um ein Absetzen der Behandlung aufgrund einer Thrombozytopenie zu vermeiden. Eine Dosisreduktion sollte auch bei PV-Patienten in Betracht gezogen werden, wenn das Hämoglobin unter 12 g / dl liegt, und eine Dosisreduktion wird empfohlen, wenn das Hämoglobin unter 10 g / dl liegt. Wenn die Behandlung als unzureichend wirksam angesehen wird und das Blutbild ausreichend ist, kann die Dosis zweimal täglich um maximal 5 mg bis zu einem Maximum erhöht werden. Dosen von 25 mg zweimal täglich. Die Anfangsdosis sollte während der ersten vier Wochen der Behandlung nicht erhöht werden und danach sollte sie nicht häufiger als in Intervallen von 2 Wochen erhöht werden. Max. Die Dosis des Präparats beträgt zweimal täglich 25 mg. Dosisanpassungen bei gleichzeitiger Einnahme von starken CYP3A4-Inhibitoren oder Fluconazol. Eine Einheitsdosis sollte um etwa 50% reduziert und zweimal täglich verabreicht werden. Die gleichzeitige Anwendung des Präparats mit Fluconazol in Dosen von mehr als 200 mg täglich sollte vermieden werden. Während der Behandlung mit starken Inhibitoren von CYP3A4 oder doppelten Inhibitoren von CYP2C9- und CYP3A4-Enzymen wird eine häufigere (z. B. zweimal wöchentliche) Überwachung der hämatologischen Parameter und der Anzeichen und Symptome von arzneimittelbedingten Nebenwirkungen empfohlen. Abbruch der Behandlung. Die Behandlung sollte fortgesetzt werden, solange das Nutzen-Risiko-Verhältnis positiv bleibt. Sie sollte jedoch nach 6 Monaten abgebrochen werden, wenn seit Beginn der Behandlung keine Verringerung der Milzgröße oder Symptomverbesserung aufgetreten ist. Es wird empfohlen, dass Patienten mit einem gewissen Grad an klinischer Verbesserung die Behandlung mit Ruxolitinib abbrechen, wenn sie eine Milzverlängerung von 40% im Vergleich zur Grundlinienlänge (ungefähr gleichbedeutend mit einer Milzausdehnung von 25%) aufweisen und keine wirkliche Verbesserung ihrer Milz beobachtet wird. in Bezug auf die mit der Krankheit verbundenen Symptome. Spezielle Gruppen von Patienten. Bei Patienten mit leichter oder mittelschwerer Nierenfunktionsstörung ist keine spezielle Dosisanpassung erforderlich. Bei Patienten mit schwerer Nierenfunktionsstörung (CCr 3 bis 200.000 / mm3) wird für MF-Patienten mit Thrombozytenzahlen> 200.000 / mm3 eine Einzeldosis von 20 mg oder 2 Dosen von 10 mg im Abstand von 12 Stunden empfohlen. Nachfolgende Dosen (einmalige Verabreichung oder 2 Dosen von 10 mg im Abstand von 12 Stunden) sollten nur an Hämodialysetagen nach jeder Dialysesitzung verabreicht werden. Die empfohlene Anfangsdosis für Hämodialysepatienten mit ESRD und PV beträgt eine einzelne Dosis von 10 mg oder zwei Dosen nach jeder Dialysesitzung. 5 mg werden alle 12 Stunden nach der Dialyse und nur am Tag der Hämodialyse verabreicht. Diese Dosierungsempfehlungen werden simuliert, und alle Dosisänderungen bei ESRD-Patienten sollten sorgfältig auf Sicherheit und Wirksamkeit überwacht werden. Bei Patienten, die sich einer Behandlung unterziehen, liegen keine Daten vor. Peritonealdialyse oder kontinuierliche veno-venöse Hämofiltration Bei Patienten mit eingeschränkter Leberfunktion basiert die empfohlene Anfangsdosis auf und o Blutplättchen sollten um ungefähr 50% reduziert und zweimal täglich verabreicht werden. Nachfolgende Dosen sollten basierend auf der Sicherheit und Wirksamkeit des Arzneimittels angepasst werden. Patienten, bei denen während der Behandlung mit dem Präparat eine Leberfunktionsstörung diagnostiziert wurde, sollten in den ersten 6 Wochen nach Beginn der Behandlung und nach Stabilisierung der Leberfunktion und Blutuntersuchungen - falls verfügbar - mindestens 1 in 1-2 Wochen eine vollständige Blutuntersuchung mit einem Abstrich durchführen lassen. klinische Indikationen. Die Dosis kann angepasst werden, um das Risiko einer Zytopenie zu verringern. Zusätzliche Dosisanpassungen bei älteren Menschen werden nicht empfohlen. Die Sicherheit und Wirksamkeit bei Kindern unter 18 Jahren wurde nicht nachgewiesen. Es sind keine Daten verfügbar. Art zu geben. Mit oder ohne Essen einnehmen. Wenn eine Dosis versäumt wird, sollten Patienten keine zusätzliche Dosis einnehmen, sondern die nächste verschriebene Dosis.
Indikationen
Markfibrose. Behandlung von Splenomegalie im Zusammenhang mit einer Krankheit oder Symptomen, die bei erwachsenen Patienten mit primärer Knochenmarkfibrose (auch als chronische idiopathische Knochenmarkfibrose bekannt), Myelofibrose mit Polyzythämie (Hyperämie) vera oder Knochenmarkfibrose mit essentieller Thrombozythämie auftreten. Büschelige Büschelente. Behandlung von erwachsenen Patienten mit Polyzythämie vera, die gegen eine Hydroxycarbamid-Therapie resistent oder intolerant sind.
Kontraindikationen
Überempfindlichkeit gegen den Wirkstoff oder einen der Hilfsstoffe. Schwangerschaft und Stillzeit.
Vorsichtsmaßnahmen
Das Medikament kann hämatologische Nebenwirkungen wie Thrombozytopenie, Anämie und Neutropenie verursachen. Daher ist vor Beginn der Behandlung ein vollständiger Bluttest mit einem Abstrich weißer Blutkörperchen erforderlich. Die Behandlung sollte bei Patienten mit einer Thrombozytenzahl von weniger als 50.000 / mm3 oder einer absoluten Neutrophilenzahl von weniger als 500 / mm3 abgebrochen werden. Es wurde festgestellt, dass Patienten mit niedrigen Thrombozytenzahlen (3) zu Beginn der Therapie mit größerer Wahrscheinlichkeit während der Behandlung eine Thrombozytopenie entwickeln. Die Thrombozytopenie ist im Allgemeinen reversibel und kann normalerweise durch Reduzieren der Dosis oder vorübergehendes Zurückhalten des Präparats behandelt werden. Abhängig von der klinischen Indikation kann jedoch eine Blutplättchentransfusion erforderlich sein. Patienten, die eine Anämie entwickeln, benötigen möglicherweise Bluttransfusionen, und bei Patienten mit Anämie können Dosisanpassungen oder ein Abbruch der Behandlung in Betracht gezogen werden. Patienten mit einem Hämoglobinspiegel unter 10,0 g / dl zu Beginn der Behandlung haben während der Behandlung ein höheres Risiko für Hämoglobinspiegel unter 8,0 g / dl als Patienten mit höheren Hämoglobin-Ausgangswerten, daher bei Patienten mit Hämoglobin-Ausgangswerten. Hämoglobin unter 10,0 g / dl, eine häufigere Überwachung der hämatologischen Parameter sowie die Beurteilung von Anzeichen und Symptomen, die auf Nebenwirkungen im Zusammenhang mit der Verwendung des Präparats hinweisen, wird empfohlen. Die Neutropenie (absolute Neutrophilenzahl <500 / mm3) war im Allgemeinen reversibel und durch vorübergehendes Halten des Arzneimittels beherrschbar. Ein vollständiger Bluttest sollte so oft wie klinisch angezeigt durchgeführt und die Dosis nach Bedarf angepasst werden. Bei Patienten, die mit dem Präparat behandelt wurden, sind schwerwiegende bakterielle, mykobakterielle, pilzliche, virale und andere opportunistische Infektionen aufgetreten. Daher sollten die Patienten auf das Risiko schwerer Infektionen untersucht werden. Ärzte sollten Patienten, die dieses Arzneimittel erhalten, sorgfältig auf Anzeichen und Symptome von Infektionen überwachen und unverzüglich eine geeignete Behandlung einleiten. Die Behandlung sollte erst begonnen werden, wenn keine ernsthafte aktive Infektion mehr vorliegt. Bei Patienten, die das Arzneimittel gegen Myelofibrose einnehmen, wurde über Tuberkulose berichtet. Patienten sollten vor Beginn der Behandlung gemäß den lokalen Empfehlungen auf aktive oder inaktive (latente) Tuberkulose getestet werden. Die Untersuchungen sollten Anamnese, mögliche frühere Kontakte mit Tuberkulose-Patienten und / oder geeignete Screening-Tests wie Lungenröntgen-, Tuberkulin-Tests und / oder gegebenenfalls Interferon-γ-Freisetzungstests umfassen. Verschreiber sollten das Risiko eines falsch-negativen Tuberkulin-Hauttests berücksichtigen, insbesondere bei schwerkranken oder immungeschwächten Patienten. Bei Patienten mit chronischer HBV-Infektion, die das Medikament einnahmen, wurde über einen Anstieg des Hepatitis B-Virus (HBV-DNA-Titer) mit oder ohne gleichzeitigen Anstieg von ALT und AST berichtet. Die Wirkung des Arzneimittels auf die Virusreplikation bei Patienten mit chronischer HBV-Infektion ist unbekannt. chronische HBV-Patienten sollten gemäß den klinischen Richtlinien behandelt und überwacht werden. Aufgrund des Risikos von Gürtelrose sollten Ärzte die Patienten anweisen, die frühen Anzeichen und Symptome zu erkennen, und empfehlen, die Behandlung so früh wie möglich zu beginnen. Bei Verwendung von Jakavi zur Behandlung von MF wurde über eine progressive multifokale Leukoenzephalopathie (PML) berichtet. Daher sollten Ärzte wachsam gegenüber Symptomen sein, die auf eine PML hindeuten, die Patienten möglicherweise nicht bemerken (z. B. kognitiv, neurologisch oder mental). Die Patienten sollten auf neue oder sich verschlechternde Symptome überwacht werden. Wenn sich solche Symptome entwickeln, sollte erwogen werden, den Patienten an einen Neurologen zu überweisen oder geeignete diagnostische Gegenmaßnahmen einzuleiten. Bei Verdacht auf PML sollte die weitere Behandlung ausgesetzt werden, bis PML ausgeschlossen wurde. Bei Patienten, die mit Ruxolitinib behandelt wurden, wurde über maligne Nicht-Melanom-Neoplasien der Haut (NMSC) (einschließlich Basalzellkarzinom, Plattenepithelkarzinom und Merkelzellkarzinom) berichtet. Bei Patienten mit erhöhtem Hautkrebsrisiko wird eine regelmäßige Hautuntersuchung empfohlen. Die Behandlung mit dem Präparat war mit einem Anstieg der Lipidparameter verbunden, einschließlich Gesamtcholesterin, HDL-Cholesterin, LDL-Cholesterin und Triglyceriden. Es wird empfohlen, die Lipidspiegel zu überwachen und Dyslipidämie gemäß den klinischen Richtlinien zu behandeln. Die Anfangsdosis sollte bei Patienten mit schwerer Nierenfunktionsstörung reduziert werden. Bei Patienten mit Nierenerkrankungen im Endstadium und MF, die eine Hämodialyse erhalten, sollte die Anfangsdosis auf der Thrombozytenzahl basieren. Nachfolgende Dosen sollten nur am Tag der Hämodialyse nach dem Ende jeder Hämodialysesitzung verabreicht werden. Zusätzliche Anpassungen der Dosierung sollten unter sorgfältiger Überwachung der Sicherheit und Wirksamkeit des Arzneimittels vorgenommen werden. Die Anfangsdosis sollte bei Patienten mit eingeschränkter Nierenfunktion um ca. 50% reduziert werden. Weitere Dosisanpassungen sollten auf der Grundlage der Arzneimittelsicherheit und -wirksamkeit vorgenommen werden. Wenn das Präparat gleichzeitig mit starken CYP3A4-Inhibitoren oder Doppelinhibitoren der CYP3A4- und CYP2C9-Enzyme (z. B. Fluconazol) verabreicht werden soll, sollte die Einheitsdosis um etwa 50% reduziert und zweimal täglich verabreicht werden. Die gleichzeitige Anwendung von Arzneimitteln mit zytoreduktivem oder hämatopoetischem Wachstumsfaktor und der Zubereitung wurde nicht untersucht. Nach Unterbrechung oder Absetzen der Behandlung können die MF-Symptome innerhalb von etwa 1 Woche wieder auftreten. Es sind Fälle bekannt, in denen Patienten, die die Behandlung mit dem Präparat abgebrochen haben, schwerere Ereignisse erleiden, insbesondere solche mit anderen akuten komorbiden Erkrankungen. Es ist nicht bekannt, ob ein plötzlicher Abbruch der Behandlung zum Auftreten dieser Ereignisse beigetragen hat. Eine allmähliche Verjüngung des Präparats kann in Betracht gezogen werden, es sei denn, ein plötzlicher Abbruch der Behandlung ist erforderlich, obwohl die Nützlichkeit einer Verjüngung der Dosis nicht nachgewiesen wurde. Das Präparat enthält Laktose - sollte nicht bei Patienten mit seltenen erblichen Problemen wie Galaktoseintoleranz, Lapp-Laktasemangel oder Malabsorption von Glukose-Galaktose angewendet werden.
Unerwünschte Aktivität
Bei Patienten mit Polyzythämie vera. Sehr häufig: Harnwegsinfektionen, CTCAE-Anämie Grad 3 (3) und Grad 3 (50.000 - 25.000 / mm3), Neutropenie Grad 3.(3) und 4 (3) CTCAE, intrakranielle Blutungen, gastrointestinale Blutungen, andere Blutungen (einschließlich Epistaxis, postoperative Blutungen und Hämaturien), Gas, CTCAE-Grad 3-Alaninaminotransferase-Erhöhung ( > 5x - 20x ULN). Gelegentlich: Tuberkulose. Bei Patienten mit Myelofibrose. Sehr häufig: CTCAE-Anämie jeglichen Grades, CTCAE-Grad-Thrombozytopenie jeden Grades, Blutungen (Blutungen, einschließlich intrakranieller und gastrointestinaler Blutungen, Blutergüsse und andere Blutungen, Blutergüsse, andere Blutungen (einschließlich Epistaxis, nach dem Eingriff und) Hämaturie), CTCAE Grad 1 und 2 Hypercholesterinämie, CTCAE Grad 1 Hypertriglyceridämie, Schwindel, CTCAE Grad 1 Alanin und Aspartat Erhöhung der Aminotransferase, Hypertonie Häufig: Harnwegsinfektionen, Herpes Zoster, Grad 3 Thrombozytopenie (50 CTCAE 000 - 25.000 / mm3), Gewichtszunahme, Verstopfung Gelegentlich: CTCAE Grad 3 (3) Anämie erhöhte Alaninaminotransferase (> 5x - 20x ULN) Nach Absetzen der Behandlung bei Patienten Bei MF kann es zu einem erneuten Auftreten von MF-Symptomen wie Müdigkeit, Knochenschmerzen, Fieber, Juckreiz, Nachtschweiß, symptomatischer Milzvergrößerung und Gewichtsverlust kommen. In klinischen Studien mit MF kehrte der Gesamt-MF-Symptom-Score innerhalb von 7 Tagen nach Beendigung der Behandlung allmählich zum Ausgangswert zurück.
Schwangerschaft und Stillzeit
Die Anwendung des Präparats während der Schwangerschaft ist kontraindiziert. Frauen im gebärfähigen Alter sollten während der Behandlung wirksame Verhütungsmethoden anwenden. Wenn eine Frau während der Behandlung mit dem Präparat schwanger wird, sollte eine individuelle Nutzen-Risiko-Bewertung mit Beratung hinsichtlich des möglichen Risikos für den Fötus durchgeführt werden. Es darf nicht während des Stillens angewendet werden. Daher sollte das Stillen zu Beginn der Behandlung abgebrochen werden.
Bemerkungen
Hat keine oder vernachlässigbare beruhigende Wirkung. Patienten, bei denen nach der Einnahme des Präparats Schwindel auftritt, sollten jedoch keine Maschinen fahren oder bedienen.
Interaktionen
Interaktionsstudien wurden nur bei Erwachsenen durchgeführt. Ruxolitinib wird durch den durch CYP3A4 und CYP2C9 katalysierten Metabolismus eliminiert. Daher können Präparate, die die Aktivität dieser Enzyme hemmen, zu einer erhöhten Exposition gegenüber Ruxolitinib führen. Bei der Verabreichung des Arzneimittels mit starken Inhibitoren von CYP3A4 (wie zum Beispiel, aber nicht beschränkt auf, iboceprevir, Clarithromycin, Indinavir, Itraconazol, Ketoconazol, Lopinavir / Ritonavir, Ritonavir, Mibefradil, Nefazodon, Nelfinavir, Posaconazol, Saquinavir, eine Einheit von telaviaprevir, telaviaprevir) 50% und zweimal täglich verabreicht. Die Patienten sollten engmaschig (z. B. zweimal pro Woche) auf mögliche Zytopenie überwacht werden, und die Dosis sollte auf der Grundlage der Sicherheit und Wirksamkeit schrittweise erhöht werden. Eine Dosisreduktion von 50% sollte in Betracht gezogen werden, wenn Präparate verwendet werden, die doppelte Inhibitoren der CYP2C9- und CYP3A4-Enzyme sind (z. B. Fluconazol). Die gleichzeitige Anwendung des Arzneimittels mit Fluconazol in Dosen von mehr als 200 mg täglich sollte vermieden werden. Bei der Einnahme von CYP3A4-Induktoren (wie Avasimib, Carbamazepin, Phenobarbital, Phenytoin, Rifabutin, Rifampin (Rifampicin), Johanniskraut (Hypericum perforatum)) sollten die Patienten engmaschig überwacht und die Dosis auf der Grundlage von Sicherheit und Wirksamkeit schrittweise erhöht werden. Bei gleichzeitiger Anwendung von Ruxolitinib mit leichten bis mittelschweren CYP3A4-Inhibitoren (wie Ciprofloxacin, Erythromycin, Amprenavir, Atazanavir, Diltiazem, Cimetidin) wird keine Dosisanpassung empfohlen. Die Patienten sollten jedoch zu Beginn der Therapie mit moderaten Inhibitoren engmaschig auf mögliche Zytopenie überwacht werden. CYP3A4: Ruxolitinib kann das intestinale P-Glykoprotein und das Brustkrebsresistenzprotein (BCRP) hemmen, was zu einer erhöhten systemischen Exposition von Substraten dieser Transporter wie Dabigatranetexilat, Cyclosporin, Rosuvastatin und möglicherweise Digoxin führen kann. Arzneimittelüberwachung (TDM) oder klinischer Zustand nach Verabreichung der genannten Substanzen. Es ist möglich, dass die potenzielle Hemmung von P-gp und BCRP im Darm minimiert wird, wenn die Zeit zwischen den Arzneimittelverabreichungen so lange wie möglich eingehalten wird. Die gleichzeitige Anwendung von hämatopoetischen Wachstumsfaktoren und der Zubereitung wurde nicht untersucht. Es ist nicht bekannt, ob die Hemmung von Janus-Kinasen (JAK) durch Jakavi die Wirksamkeit von hämatopoetischen Wachstumsfaktoren verringert oder ob hämatopoetische Wachstumsfaktoren die Wirksamkeit des Präparats beeinflussen. Die gleichzeitige Anwendung von zytoreduktiven Therapien und der Zubereitung wurde nicht untersucht - die Sicherheit und Wirksamkeit der gleichzeitigen Verabreichung dieser Arzneimittel ist unbekannt. Ruxolitinib hemmt den Metabolismus des oralen CYP3A4-Substrats Midazolam nicht. Daher wird bei gleichzeitiger Anwendung dieser Arzneimittel mit Jakavi kein Anstieg der Exposition gegenüber CYP3A4-Substraten erwartet. Das Präparat hat keinen Einfluss auf die Pharmakokinetik eines oralen Kontrazeptivums, das Ethinylestradiol und Levonorgestrel enthält. Daher ist nicht zu erwarten, dass die Wirksamkeit von Kontrazeptiva, die diese Kombination enthalten, bei gleichzeitiger Anwendung von Ruxolitinib verringert wird.
Das Präparat enthält die Substanz: Ruxolitinib
Erstattete Droge: NEIN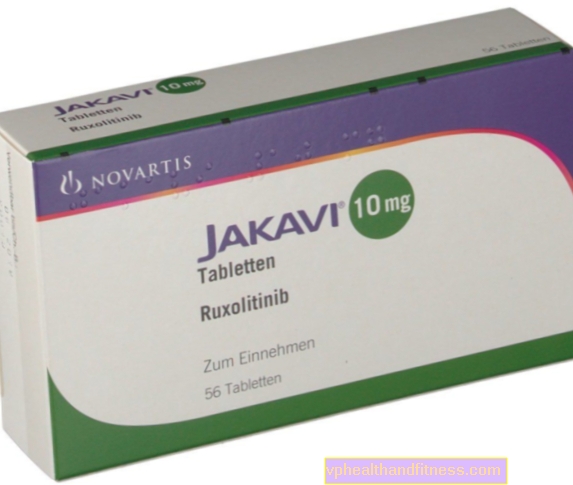






.jpg)